请选择
返回
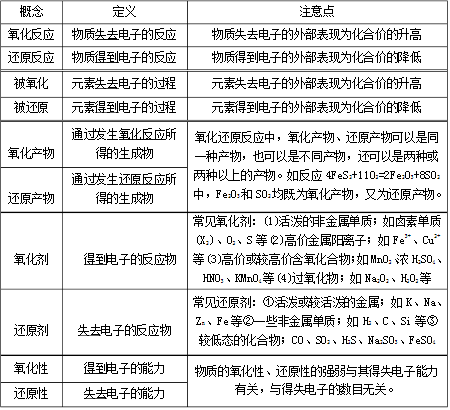
氧化-还原反应是化学反应前后,元素的氧化数有变化的一类反应。

氧化还原反应
凡是有元素化合价升降的反应都是氧化还原反应。
氧化还原反应的本质:电子的转移(包括电子的得失和电子对的偏移)
氧化还原反应的特征:化合价的升降(这也是氧化还原反应判断的依据)
在氧化还原反应中,氧化反应和还原反应是同时进行的。
对于物质所含元素化合价升高的反应是氧化反应,对于物质所含元素化合价降低的反应是还原反应。
在这个反应中,铁元素的化合价从0价升高到了+2价,发生了氧化反应;铜元素的化合价从+2价降到0价,发生了还原反应。
氧化还原反应的五条基本规律
(1)电子得失守恒规律:氧化剂得到电子总数=还原剂失去电子总数;
(2)“以强制弱”规律:氧化剂+还原剂=较弱氧化剂+较弱还原剂;这是氧化还原反应发生的条件。
(3)价态归中规律:同一元素不同价态间发生的氧化还原反应,化合价的变化规律遵循:高价+低价→中间价态,中间价态可相同、可不同,但只能靠近不能相互交叉(即价态向中看齐)。
KClO3+6HCl =KCl+3Cl2+3H2O 而不是KClO3+6HCl=KCl+3Cl2+3H2O
(4)歧化反应规律:发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:
Cl2十2NaOH=NaCl十NaClO十H20
(5)优先反应原理:
在溶液中如果存在多种氧化剂(还原剂),当向溶液中加入一种还原剂(或氧化剂)时,还原剂(或氧化剂)先把氧化性(或还原性)强的氧化剂(或还原剂)还原(或氧化)。
基本概念
以上就是小编整理的氧化还原反应知识点,感谢阅读。