请选择
返回
水是一种极弱的电解质,能发生微弱的电离,其电离方程式为H2O===H++OH-。影响水的电离平衡的因素:温度:升高温度,促进水的电离,Kw增大;降低温度,抑制水的电离,Kw减小。溶液的酸碱性:向纯水中加酸(或碱),使水溶液中c(H)或c(OH)增大,水的电离平衡逆向移动,抑制水的电离。

水的电离方程式
水是一种极弱的电解质,能发生微弱的电离,其电离方程式为
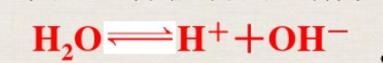
影响水的电离平衡的因素
(1)温度:升高温度,促进水的电离,Kw增大;降低温度,抑制水的电离,Kw减小。
(2)溶液的酸碱性:向纯水中加酸(或碱),使水溶液中c(H)或c(OH)增大,水的电离平衡逆向移动,抑制水的电离。
(3)盐效应:向纯水中加入含弱酸阴离子或弱碱阳离子的盐,水的电离平衡向电离方向移动,促进水的电离。
(4)活泼金属:与水电离出的氢离子反应,使氢离子浓度减小,促进水的电离。
水的电离是放热还是吸热
电离是吸热的,吸热的不多,一般溶解是吸热的,可以近似是看成是电离的过程。
放热的一般有:
化合反应,例如物质的燃烧。
金属和酸,和水反应,例如钙,钠等活泼金属投入水中的反映。
酸碱中和反应
吸热一般有:
分解反应,比如实验室利用高锰酸钾制氧气,注意用词,以上是一般,不是一定。
从微观的角度出发,如果反应的过程中有化学键的合成的,那就是吸热的,如果有化学键断裂的,那就是放热的。