请选择
此试题可能存在乱码情况,在查看时请点击右上角全屏查看
2018年怀化中考化学酸碱盐专项训练
(时间:90分钟 满分:100分)
一、选择题(本题包括8小题,每小题2分,共16分)
1. 下列叙述不正确的是( )
A. 可用食醋除去热水瓶中的水垢
B. 在铁桶中较长时间配制硫酸铜溶液
C. 可用稀硫酸除去铁锈
D. 可用消石灰改良酸性土壤
2. 将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( )
A. HNO3和FeCl3 B. NaOH和HCl
C. BaCl2和Na2SO4 D. KOH和CuSO4
3.在氯化钡溶液中滴入某种溶液,生成白色沉淀。有关说法错误的是( )
A. 滴入的可能是硝酸银溶液 B. 反应后溶液可能呈酸性
C. 白色沉淀可能溶于盐酸 D. 该反应可能是中和反应
4.在“P+Q→盐+水”的反应中,物质P和Q不可能是( )
A. HCl和Ca(OH)2 B. SO2和NaOH
C. Fe2O3和H2SO4 D. H2SO4和ZnCl2
5.下列物质之间的转化,经过一步反应不能实现的是( )
A. CuCl2→KCl B. KNO3→K2SO4
C. Fe(OH)3→Fe2(SO4)3 D. BaCl2→BaCO3
6.下列各组物质的溶液不用其他试剂无法鉴别的是( )
A. H2SO4 NaCl Na2CO3 CaCl2 B. HCl NaOH CuSO4 MgSO4
C. Na2CO3 K2SO4 BaCl2 HCl D. NaNO3 HCl CaCl2 KOH
7.甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示。关于该转化关系图,下列说法正确的是( )

第7题图
A. 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠
B. 若甲、乙、丁都是氧化物,则丙一定是碳酸钙
C. 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现
D. 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳
8. 小明向盛有盐酸和MgCl2溶液的烧杯中加入一定量的NaOH溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液a于试管中,用下表中的试剂进行实验。相应结论错误的是( )
选项 | 试剂 | 现象和结论 |
A | Zn粉 | 有气泡产生,则溶液a一定有MgCl2 |
B | CuO粉末 | 无明显现象,则溶液a一定有两种溶质 |
C | NaOH溶液 | 无明显现象,则溶液a可能有NaOH |
D | CuSO4溶液 | 有蓝色沉淀,则溶液a一定有两种溶质 |
二、填空及简答题(本题包括8小题,共54分)
9.(6分)实验室有4种试剂,分别为HNO3溶液、CuSO4溶液、MgCl2溶液和KOH溶液。
(1)有颜色的试剂是________。
(2)有一种试剂能与另外三种试剂发生反应,该试剂是________。
(3)书写化学方程式:
①CuSO4溶液与KOH溶液混合:______________________________。
②HNO3溶液与NaHCO3溶液混合:______________________________。
10. (7分)二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳____________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为(用化学方程式表示)______________________________。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有________,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强________(“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为__________________________。
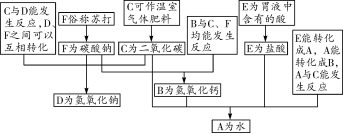
11. ((6分)如图是初中化学中几种常见物质间的反应及转化关系,C可作温室气体肥料,E是胃液中含有的酸,F俗称苏

第11题图
打。图中“——”表示两端的物质能发生反应,“―→” 表示一种物质可转化为另一种物质。
请完成下列反应的化学方程式:
(1)E——F反应的化学方程式
______________________________。
(2)B——F反应的化学方程式______________________________。
(3)E―→ A反应的化学方程式____________________________________【与(1)中所答化学方程式不得重复】。
12. (5分)氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
![]()
第12题图
(1)分离A中难溶物的操作Ⅰ叫________。
(2)如果要用实验证明B中不是水而是一种溶液,可以选择下列________(填序号)进行实验。
①稀盐酸 ②二氧化碳 ③氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清溶液出现白色固体,如果加入的是饱和碳酸钠溶液,则反应的化学方程式为________________________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是________。
13. (9分)酸、碱、盐及氧化物在生产、生活中应用广泛,使用时必须规范科学。请你根据它们的性质回答下列问题:
(1)有Bad(OH)2溶液、稀H2SO4、Bad(NO3)2溶液、石灰石、小苏打、生石灰等六种物质,其中常用于改良酸性土壤的是________________;写出其中能发生中和反应的化学方程式__________________________________。
(2)实验室有三瓶失去标签的试剂:稀HCl、NaOH溶液、CuSO4溶液,不用其他任何试剂就可将它们鉴别出来,其中最先鉴别出来的物质是________,写出鉴别过程中发生反应的化学方程式______________________________。
(3)NaOH溶液、澄清石灰水在空气中长期敞口放置易变质,写出NaOH在空气中变质的化学方程式____________________________,要除去已变质的澄清石灰水中少量的杂质,采用的有效方法是__________________。
14. (6分)(1)盐酸、硫酸是常见的两种酸。

第14题图
①打开装浓盐酸的试剂瓶时,瓶口出现白雾,说明浓盐酸具有________性。
②用水稀释浓硫酸时,______________________________并用玻璃棒搅拌即可。
(2)如图是化肥硝酸铵包装袋上的部分说明:
①从说明上可以判断硝酸铵应具有的性质有____________(填字母)。
A. 易溶于水 B. 撞击易爆炸 C. 受热易分解
②若把硝酸铵溶于水配成溶液并用pH试纸检测溶液酸碱性,发现常温下溶液的pH=6,则该盐溶液呈________(填“酸性”、“碱性”或“中性”)。
③硝酸铵与碱反应生成硝酸盐、氨气和水,由于氨气挥发而导致肥效减弱,故施用硝酸铵时,要避免与碱性物质混合使用,写出硝酸铵与熟石灰在加热条件下反应的化学方程式________________________________________。
15. (3分)有一包固体粉末可能含有Na2CO3、FeCl3、CaCl2、NaOH中的一种或几种。为探究它们的成分,进行如下实验。①取少量该固体粉末加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;②向滤液中滴加酚酞溶液,溶液变红。
根据上述实验回答下列问题:
(1)粉末中一定不含________,一定含有______________。
(2)为了确定可能含有的物质,取少量②中红色溶液于试管中,加入过量的________溶液,若溶液仍为红色,则证明该物质一定存在。
16.(12分)通过分析表格、总结规律及含义是培养学生能力的重要手段。下表是“部分酸、碱、盐在20 ℃时的溶解性”。
| OH- | NO | Cal- | CO | SO |
|
H+ | - | 溶、挥 | 溶、挥 | 溶、挥 | 溶 |
|
Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
|
Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
|
Mg2+ | 不 | 溶 | 溶 | 微 | 溶 |
|
请回答下列问题:
(1)查:BaCO3溶解性为________。
(2)写化学式:一种酸________,一种不溶于水的碱________。
(3)写出碳酸钠溶液与氯化钡溶液反应的化学方程式__________________________;该反应的基本反应类型为____________。
(4)氯化钠溶液________(填“能”或“不能”)与硝酸钡溶液发生反应,判断理由是__________________________。
(5)已知难溶的物质在一定条件下可转化成更难溶的物质。将白色氢氧化镁加到FeCl3溶液中有红褐色沉淀生成,请写出反应的化学方程式并简述理由_________________________。
(6)下列各组离子在溶液中不能大量共存的是________(填编号)。
A. Na+、Ba2+、NO、Cal- B. Cu2+、SO、Ba2+、Cal-
C. Ca2+、NO、Cal-、H+ D. H+、Ba2+、Cal-、NO
三、实验探究题(本题包括3小题,共24分)
17. (6分)实验中学化学兴趣小组的同学以“酸碱中和反应”为课题进行探究。小翔同学向烧杯中的氢氧化钙溶液滴加稀盐酸,当他滴加一定量的稀盐酸,发现忘了加入指示剂,于是他停止了滴加稀盐酸。此时,小翔检验烧杯溶液中含有哪些溶质?
(1)该中和反应的化学方程式为________________________________。
(2)下面是小翔同学设计的实验方案。
方案 | 方法步骤 | 实验现象 | 实验结论 |
方案一 | 取少量烧杯中的溶液于洁净试管中,滴入几滴无色酚酞溶液 |
|
|
酚酞不变红色 | 溶质只有氯化钙 |
|
|
酚酞变红色 | 溶质是氯化钙 和氢氧化钙 |
|
|
方案二 | 另取少量烧杯中的溶液于洁净试管中,加入锌粒 | ________ | 溶质是氯化 钙和氯化氢 |
①写出方案二中的实验现象。
②同学们经过讨论后认为方案一存在缺陷,请你说明原因。
(3)小翔同学认为反应后的溶液需经过处理才能倒入下水道,请你设计实验使该溶液中的溶质只含有氯化钙。
18.(10分)氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得。
(1)工业上利用氮气和氢气反应制氨气;反应的化学方程式为_____________________(不要求注明条件)。
(2)小华为探究氨气溶于水是否发生化学反应,设计并完成如下实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
①________________________ | ②____________________ |
(3)小明将滴有酚酞的稀氨水加热,观察到溶液红色变浅,原因可能是___________________________________________。
(4)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化。为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度________(填“增大”、“减小”或“不变”)。
(5)为除去氯化钠溶液中的碳酸钠,小林设计了如下方案:
![]()
第18题图
你认为上述方案________(填“合理”或“不合理”),请分析:____________________(如合理,说明原因;如不合理,说明原因并设计改进方案)。
19. (8分)某学校化学兴趣小组同学在实验室发现一瓶忘了盖瓶盖的NaOH固体,对其成分是否变质以及变质程度产生了兴趣。同学们作出了以下猜想,并进行如下实验探究。
【提出问题】这瓶NaOH固体样品的成分是什么呢?
【作出猜想】猜想1:只含NaOH
猜想2:只含Na2CO3
猜想3:含有NaOH和Na2CO3
【讨论交流】NaOH可能变质的原因是________________________(用化学方程式表示)。
【实验探究】(1)取少量样品于试管中,加入足量稀盐酸,有气泡产生,说明猜想________不成立。
(2)进一步探究过程如下:
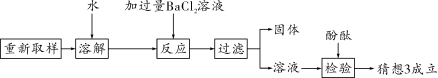
第19题图
根据上述探究过程回答:
①加入过量BaCl2溶液的作用是____________________________________________;
②不能用适量Bad(OH)2溶液代替过量BaCl2溶液的原因是_______________________;
③下列溶液可用来代替酚酞试液检验猜想3成立的是________(填字母序号)。
A. CuCl2溶液 B. KNO3溶液 C. CaCl2溶液 D. NH4Cl溶液
【实验反思】实验室里,NaOH固体的保存方法是________________。
四、计算题(本题包括1小题,共6分)
20. (6分)为测定21.2 g某变质氢氧化钠固体中碳酸钠的含量,将其配成500 mL溶液,分别取出50 mL,用两种方法进行测定。已知:Na2CO3+BaCl2=== BaCO3↓+2NaCl
| 加入的试剂 | 测得数据 |
方法1 | 足量BaCl2溶液 | BaCO3沉淀1.97 g |
方法2 | 足量稀硫酸 | CO2气体0.44 g |
请任选1· 种方法的数据,计算该固体中碳酸钠的质量分数(写出计算过程及结果)
2018年怀化中考化学酸碱盐专项训练参考答案
1. B 【解析】水垢的主要成分是碳酸钙,食醋中含有醋酸,碳酸钙能与醋酸反应,因此可用食醋除去热水瓶中的水垢,A正确;铁能与硫酸铜溶液反应生成硫酸亚铁和铜,不可在铁桶中较长时间配制硫酸铜溶液,B不正确;铁锈的主要成分是氧化铁,氧化铁能与稀硫酸反应,可用稀硫酸除去铁锈,C正确;消石灰的主要成分是氢氧化钙,显碱性,可用消石灰改良酸性土壤,D正确。
2. B 【解析】溶于水得到无色溶液说明不含在水溶液中有颜色的物质,物质间不反应或发生反应但不生成沉淀。硝酸与氯化铁不反应,但氯化铁溶液显黄色,A错误;氢氧化钠与盐酸都是无色的,虽然会反应,但生成氯化钠溶液和水,无沉淀生成,B正确;氯化钡与硫酸钠反应生成白色沉淀硫酸钡,C错误;氢氧化钾与硫酸铜反应生成蓝色沉淀氢氧化铜,D错误。
3. D 【解析】中和反应是酸与碱反应生成盐和水的反应,氯化钡是盐,既不是酸也不是碱,所以在氯化钡溶液中滴入某种溶液,生成白色沉淀,不可能是中和反应。
4. D 【解析】NaOH、Ca(OH)2是碱,H2SO4、HCl是酸,SO2是酸性氧化物,Fe2O3是金属氧化物,ZnCl2是盐。酸和碱反应生成盐和水;酸和金属氧化物反应生成盐和水, 碱和酸性氧化物反应生成盐和水;氯化锌与硫酸不反应。故选D。
5. B 【解析】CuCl2可与KOH反应生成KCl和Cu(OH)2沉淀,可一步实现,A正确;钾离子和硝酸根离子都不能生成沉淀、气体或水,所以一步反应不能实现,B错误;Fe(OH)3与H2SO4反应可生成Fe2(SO4)3和H2O,可一步实现,C正确;BaCl2和Na2CO3反应可生成BaCO3 沉淀和NaCl,可一步实现,D正确。
6. D 【解析】将A中四种物质两两混合,其中一种物质与另外三种物质混合分别产生气泡、沉淀、无现象,则该物质是碳酸钠,与碳酸钠混合产生气泡、沉淀、无现象的分别是硫酸、氯化钙、氯化钠,A可以鉴别;B中溶液为蓝色的是硫酸铜,然后将硫酸铜分别滴到其余三种无色溶液的样品中,产生蓝色沉淀的是氢氧化钠,将氢氧化钠滴到其余两种无色液体中,产生白色沉淀的是硫酸镁,无现象的是盐酸,B可以鉴别;将C中四种物质两两混合,其中一种物质能与其他三种物质分别产生白色沉淀、白色沉淀、无现象,则该物质是氯化钡,与氯化钡混合无明显现象的是盐酸,然后将盐酸分别滴加到与氯化钡反应产生白色沉淀的两种溶液中,与盐酸混合产生气泡的是碳酸钠,无现象的是硫酸钾,C可以鉴别;将D中四种物质两两混合都无明显现象,D不用其他试剂无法鉴别。
7. C 【解析】根据转化关系图将各选项带入验证,A选项代入发现甲是硝酸钠,不能转化成氢氧化钠,A错误;B选项中,当甲为CO、乙为CO2、丁为水,丙还可以是碳酸氢钠,B错误;C选项当甲为碳酸钠,乙为氢氧化钠,丙为氢氧化钙,丁为水时,可通过复分解反应实现,C正确;D选项中丙还可以是CH4等气体,D错误。故选C。
8. B
9. (6分)(1)CuSO4溶液(1分) (2)KOH溶液(1分)
(3)①CuSO4+2KOH=== K2SO4+Cu(OH)2 ↓(2分) ②HNO3+NaHCO3=== NaNO3+H2O+CO2↑(2分)
10. (7分)(1)能溶于水(1分) (2)CO2+Ca(OH)2=== CaCO3↓+H2O(2分) (3)氢氧化钠(或NaOH)(1分) 酸(1分) (4)2NaCl+2H2O 2NaOH+ H2↑+Cl2↑(2分)
【解析】(1)因为二氧化碳能溶于水,所以可用于制作碳酸饮料。(2)石灰浆能与空气中的二氧化碳反应使墙壁又白又硬,反应的化学方程式为CO2+Ca(OH)2=== CaCO3↓+H2O。(3)氢氧化钠能清洁油污,和油污发生化学反应;厕所清洁剂呈酸性,能用于消毒杀菌。(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O 2NaOH+ H2↑+Cl2↑。
11. (6分)(1)Na2CO3+2HCl=== 2NaCl+H2O+CO2↑(2分) (2)Na2CO3+Ca(OH)2=== CaCO3↓ + 2NaOH(2分) (3)2HCl+Mg(OH)2=== MgCl2+2H2O(合理即可)(2分)
【题眼定位】
12. (5分)(1)过滤(1分) (2)②(1分) (3)Ca(OH)2+Na2CO3=== 2NaOH+CaCO3↓(2分) Ca(OH)2(1分)
13. (9分)(1)生石灰(1分) H2SO4+Ba(OH)2=== BaSO4↓+2H2O(2分) (2)CuSO4溶液(1分) 2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4(2分) (3)2NaOH+CO2=== Na2CO3+H2O(2分) 过滤(1分)
【解析】(1)生石灰溶于水生成熟石灰,熟石灰能与土壤中的酸反应;中和反应是酸与碱反应生成盐和水的反应,硫酸与氢氧化钡的反应是中和反应,反应的化学方程式为H2SO4+Ba(OH)2=== BaSO4↓+2H2O;(2)硫酸铜溶液呈蓝色,直接观察溶液的颜色就能鉴别出来;然后分别取少量硫酸铜溶液于两支试管中,再将另外两种溶液分别加入试管中,若产生蓝色沉淀,则该试管中加入的溶液为氢氧化钠,则另一支试管中加入的是稀盐酸,稀盐酸与硫酸铜不反应,故鉴别过程中发生反应的化学方程式为2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4;(3)氢氧化钠变质的实质是氢氧化钠与空气中的二氧化碳反应,反应的化学方程式为2NaOH+CO2=== Na2CO3+H2O;澄清石灰水变质的实质是氢氧化钙与空气中的二氧化碳反应生成碳酸钙,碳酸钙不溶于水,可通过过滤的方法除去。
14. (6分)(1)①挥发(1分) ②将浓硫酸沿烧杯内壁缓慢的注入盛有水的烧杯里(1分) (2)①A、B、C(1分) ②酸性(1分) ③2NH4NO3 +Ca(OH)2 Ca(NO3)2+2NH3↑+2H2O(2分)
15. (3分)(1)FeCl3(1分) Na2CO3、CaCl2(1分) (2)氯化钙(或氯化钡)(1分)
【解析】(1)为了探究固体的成分,将少量该固体粉末加入足量水中,得到白色沉淀和无色滤液,由此可知原固体中一定不含FeCl3,一定含有Na2CO3和CaCl2;向滤液中滴加酚酞溶液,溶液变红色,滤液显碱性,可能存在NaOH,也可能是碳酸钠有剩余。(2)为了进一步确定NaOH是否存在,取少量变红色的滤液于试管中,加入过量的氯化钙或氯化钡溶液,目的是为了除去可能存在剩余的碳酸钠,发生的反应为CaCl2+Na2CO3=== CaCO3↓+2NaCl或BaCl2+Na2CO3=== BaCO3↓+2NaCl,若溶液仍显红色,则说明原固体粉末中一定含有NaOH。
16. (12分)(1)不溶 (1分) (2)HNO3(合理即可)(1分)
Mg(OH)2(1分) (3)BaCl2+Na2CO3=== BaCO3↓+2NaCl(2分) 复分解反应(1分) (4)不能(1分) 因为反应后没有沉淀、气体或水生成(1分) (5)3Mg(OH)2+2FeCl3=== 2Fe(OH)3+3MgCl2(2分);氢氧化铁比氢氧化镁更难溶于水(1分) (6)B (1分)
【解析】(1)查表格可知,BaCO3是不溶性固体。(2)酸是由氢离子和酸根离子构成的,因而表格中可组成的酸的化学式为HNO3、HCl、H2CO3、H2SO4;碱是由金属离子或铵根离子和氢氧根离子构成的,表格中能组成的碱的化学式为:NaOH、Ba(OH)2、Mg(OH)2,其中Mg(OH)2是不溶于水的碱。(3)BaCl2中的Ba2+和Na2CO3中的CO不共存,能生成不溶于水的BaCO3沉淀,反应的化学方程式为BaCl2+Na2CO3===BaCO3↓+2NaCl;该反应中两种化合物相互交换成分生成了另外的两种化合物,反应类型属于复分解反应。(4)NaCl溶液与Ba(NO3)2溶液混合时,没有沉淀、气体或水生成,因而两种物质不能发生反应。(5)不溶性的Mg(OH)2和黄色的FeCl3溶液反应能生成红褐色的Fe(OH)3的沉淀,同时还生成了MgCl2,该反应的化学方程式为3Mg(OH)2+2FeCl3=== 2Fe(OH)3+3MgCl2;由题意可知:难溶的物质在一定条件下可以转变成更难溶的物质,由于氢氧化铁和氢氧化镁都是不溶性的固体,该反应中氢氧化镁能制取氢氧化铁,据此可以说明氢氧化铁比氢氧化镁更难溶于水。(6)不共存的离子之间能反应生成沉淀、气体或水,A、C、D中的各种离子之间都能共存,相互之间不会发生化学反应;B中的SO和Ba2+不共存,会生成BaSO4白色沉淀;只有B中离子不能共存。
17. (6分)(1)Ca(OH)2+2HCl=== CaCl2+2H2O(2分) (2)①有气泡产生(1分) ②盐酸也不能使酚酞溶液变色,盐酸过量溶液也为无色(1分) (3)含有盐酸的废液直接倒入下水道,会污染水体,腐蚀铁制下水道,需要加入过量的碳酸钙使其转变为中性溶液后再排放(2分)
【解析】(1)氢氧化钙与盐酸反应生成易溶的氯化钙和水。(2)在分析反应后所得溶液中溶质的成分时,除了需要考虑反应的生成物外,还应考虑反应物是否有剩余。氢氧化钙与盐酸反应生成氯化钙和水,反应所得溶液中的溶质一定有氯化钙,可能有剩余的反应物氯化氢或氢氧化钙。在反应后的溶液中加入酚酞溶液,溶液不变色,只能说明溶液不显碱性。因为盐酸也不能使酚酞溶液变色,盐酸过量溶液也为无色。在含有盐酸的溶液中加入锌粒,锌与盐酸反应生成氢气,会有气泡冒出。(3)含有盐酸的废液直接倒入下水道,会污染水体,腐蚀铁制下水道,需要加入过量的碳酸钙使其转变为中性溶液后再排放。
18. (10分)(1)N2+3H2=== 2NH3(2分) (2)①向上述集气瓶中的滤纸上滴入少量水(合理即可)(1分) ②滤纸变红,说明二者发生了反应(1分) (3)氨水受热分解,随温度升高氨气溶解度减小,导致氨水浓度降低(合理即可)(1分) (4)增大(1分) (5)不合理(1分) 根据上述实验,加热煮沸无法除去溶液A中混有的过量的HCl(1分)改进方案:向含碳酸钠的氯化钠溶液中边滴加盐酸,边测定溶液的pH,至溶液呈中性即可(合理即可)(2分)
19. (8分)【讨论交流】CO2+2NaOH=== Na2CO3+H2O(2分) 【实验探究】(1)1(1分) (2)①除去溶液中的Na2CO3,防止对NaOH的检验造成干扰(1分) ②加入Ba(OH)2会生成NaOH[或Ba(OH)2+ Na2CO3=== BaCO3↓+2NaOH](2分) ③AD(1分) 【实验反思】密封保存(1分)
【解析】【讨论交流】氢氧化钠易与空气中的二氧化碳反应生成碳酸钠和水而变质,反应的化学方程式为CO2+2NaOH=== Na2CO3+H2O。【实验探究】(1)稀盐酸与氢氧化钠反应生成氯化钠和水,稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳;样品中加入足量的稀盐酸,有气泡产生,说明样品中含有碳酸钠,故猜想1不成立。(2)①鉴别猜想2、猜想3,实质上是鉴别氢氧化钠的有无;碳酸钠溶液与氢氧化钠溶液都显碱性,样品中加入酚酞,酚酞都会变红;样品中先加入氯化钡,氯化钡与碳酸钠反应生成碳酸钡沉淀和中性的氯化钠溶液,氯化钡过量,碳酸钠完全反应,反应后溶液显中性,再加入酚酞,酚酞变红,猜想3成立,酚酞不变色,猜想2成立;故加入过量氯化钡的目的是除去溶液中的碳酸钠,防止对氢氧化钠的检验造成干扰。②若用氢氧化钡代替氯化钡,氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,溶液一定呈碱性,故不能用氢氧化钡代替氯化钡。③验证猜想3实质上是检验氢氧化钠的存在,可以用酸碱指示剂或测pH的方法检验氢氧根离子的存在;也可用与氢氧根离子反应生成有明显现象的沉淀或气体的盐溶液。氯化铜与氢氧化钠反应生成蓝色的氢氧化铜沉淀、氯化铵与氢氧化钠反应生成无色有刺激性气味的气体,硝酸钾、氯化钙与氢氧化钠溶液混合不反应,无现象;故能代替无色酚酞试液的溶液是A、D。【实验反思】氢氧化钠固体暴露在空气中易吸水潮解,且氢氧化钠与二氧化碳反应会变质,故氢氧化钠固体应该密封保存。
20. (6分)方法一
解: 设50 mL溶液中含碳酸钠的质量为x
Na2CO3+BaCl2===BaCO3↓+2NaCl(2分)
106 197
x 1.97 g
=(1分) x=1.06 g(1分)
则该变质氢氧化钠固体中碳酸钠的含量=1.06 g×=10.6 g(1分)
固体中碳酸钠的质量分数=×100%=50%(1分)
答:该固体中碳酸钠的质量分数为50%。
方法二
解:设50 mL溶液中含碳酸钠的质量为x
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O(2分)
106 44
x 0.44 g
=(1分)
x=1.06 g(1分)
则该变质氢氧化钠固体中碳酸钠的含量=1.06 g×=10.6 g(1分)
固体中碳酸钠的质量分数=×100%=50%(1分)
答:该固体中碳酸钠的质量分数为50%。