请选择
![]()

一、选择题(本愿包括20小题,每小题只有一个选项符合题意。每小题3分,共60分)
1.下列变化属于化学变化的是
A.清精燃烧 B.水变成水蒸气 C.玻璃破碎 D.汽油挥发
2.下列说法正确的是
A.在化学变化中,分子不能再分
B.墙内开花墙外香,说明分子在不断运动
C.原子核由电子和中子构成
D.不同元素最本质的区别是相对原子质量不同
3.下列说法正确的是
A.天然气可以作燃料 B.过滤可以将硬水软化
C.水由氢气和氧气组成 D.大量施用化肥、农药不会污染环境
4.下列做法错误的是
A.使用完酒精灯后,用灯帽盖灭 B.在钢铁表面刷油漆防止生锈
C.不挑食,合理摄入人体必需元素 D.焚烧废弃塑料减少白色污染
5.通常状况下,乙烯(C2H4)是一种无色气体,具有可燃性,其燃烧反应的化学方程式为:C2H4+302![]() 2X+2H2O,则下列有关说法正确的是
2X+2H2O,则下列有关说法正确的是
A.氧气中氧元素的化合价为-2价
B.水属于有机化合物
C.X中碳、氧元素的原子个数比为1:2
D.该反应属于化合反应
6.某化学兴趣小组用下图所示的装置来制取干燥的氧气,并测定H2O2溶液中容质的质量分数。装置气密性良好,图中的锥形瓶内盛有质量为m的H2O2溶液,燃烧匙内装有二氧化锰,燃烧匙可以上下移动,干燥管内装有足量碱石灰(CaO和NaOH的混合物)。下列说法正确的是

A.将装置I分别与装置II、III、IV、V连接,均能达到实验目的
B.称量装置I反应前及完全反应冷却后的质量,可计算出H2O2溶液中容质的质量分数
C.若用装置IV收集氧气,可将带火星的木条放置在b导管口处验满
D.若用装置V测景生成氧气的体积,集气瓶上方原有的空气会使测量结果偏大
7.氧化物、酸、碱、盐都属于化合物。甲、乙、丙、丁、M是初中化学常见的化合物,其中甲、乙、丙、丁分属上述四种不同类别的化合物,M与甲属于同种类别的化合物。它们之间的部分转化关系如图所示(部分反应物、生成物、反应条件已略去。“—”表示物质之间能发生反应, “→”表示物质之间的转化关系)。下列推论错误的是
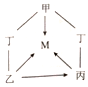
A.若甲是碳酸钙,则可以用水鉴别乙和丙
B.若乙可用于改良酸性土壤,则甲可以是氧化铜
C.若丙是碳酸钠,则甲与丁溶液混合可以得到黄色溶液
D.若丁是氢氧化钠,则甲可以通过中和反应转化为M
8.医疗上常用硫酸钡作透视肠胃的内服剂,俗称“钡餐”。一旦误将碳酸钡代替硫酸钡作“钡餐” ,就会致人中毒,此时可服用硫酸镁溶液解毒。某化学兴趣小组用如下实验模拟了碳酸钡在胃液中的变化,并验证了硫酸镁解毒的原理:
I.取一定量碳酸钡固体于烧杯中,逐滴加入稀盐酸至过量,并不断搅拌,饶杯内固体质量与加入稀盐酸的质量关系如图甲所示;
II.再向该烧杯中逐滴加入硫酸镁溶液,并不断搅拌,烧杯内溶波质量与加入硫酸镁溶液的质量关系如图乙所示。

下列有关说法正确的是
A.图甲中K点和L点时,溶液中的溶质都为一种;图乙中M点和N点时,溶液中的溶质都为两种
B.取少量步骤I所得溶波于试管中,滴加硝酸银溶液和足量稀硝酸,有白色沉淀生成,说明步骤I中加入的稀盐酸已过量
C.根据图乙数据分析,步骤II最终生成硫酸钡沉淀的质量为4.5g
D.硫酸镁解毒的原理是:MgSO4+BaCl2=MgCl2+BaSO4↓。因此,本身无毒且能与氯化钡反应生成沉淀的物质,如纯碱也可解毒
28.(4分)在通常状况下,硫是一种黄色粉末,下图是硫元素的某种粒子的结构示意图: 
(1)硫原子的核内质子数为_________。
(2)图中所示粒子的符号为_________。
(3)硫在氧气中燃烧,发出蓝紫色火焰,该反应的化学方程式为__________。
29.(4分)硝酸钾和氯化钾的溶解度曲线如下图所示:

(1)t1℃时,硝酸钾的溶解度为________。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为__________。
(3)t2℃时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是_____。
(4)将t3℃时硝酸钾和氯化钾的饱和溶液各100g分别蒸发10g水,然后降温至t2℃,过滤,得到溶液a和溶液b。对于溶液a和溶液b,下列说法正确的是____。
A.都是饱和溶液 B.溶液质量a<b C.溶质质量a=b
D.溶剂质量a<b E.溶质的质量分数a=b
30.(6分)实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用下图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:碳酸氢铵受热易分解,反应的化学方程式为: NHHCO3![]() NH3↑+H2O↑+CO2↑,NH3能被酸溶液吸收。
NH3↑+H2O↑+CO2↑,NH3能被酸溶液吸收。

部分实验步骤如下:
I.打开弹簧夹,通入段时间的氮气;
II.关闭弹簧夹,给碳酸氢铵样品加热;
III.当样品反应完全,……再停止加热,直到玻璃管冷却;
V.实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)NH4HCO3属于____(选填 “氮肥”“磷肥”“钾肥”或“复合肥”);装置B中盛放的液体是_____。
(2)装置C中发生反应的化学方程式为__________。
(3)步骤III中,停止加热前应进行的操作是___________。
(4)该样品中碳酸氢铵的质量分数的表达式为_______(用m1、m2的代数式表示)。
31.(6分)有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如下图所示实验:

(1)向样品中加入过量稀盐酸产生的气体是_________。
(2)向固体A中加入硝酸银溶液,发生反应的化学方程式为__________。
(3)固体B中含有的物质是__________。
(4)原固体样品中一定含有的物质是__________。
(5)蓝色溶液丙中一定含有的溶质是_________。
32.(6分)某氧化钠样品中含有氯化镁。为测定其中氣化钠的质量分数,称量5.00g样品于烧杯中,加适量水完全溶解,然后逐滴加入氢氧化钠溶液至恰好完全反应,生成0.58g沉淀。请回答下列问题:
(1)氢氧化钠溶液可使紫色石蕊溶液变成_____色。
(2)计算该样品中氧化钠的质量分数。

一、选择题
1.A 2.B 3.A 4.D 5.C 6.B 7.D 8.A
二、非选择题
28.(1)16 (2)S2- (3) S+O2![]() SO2
SO2
29.(1)25g (2)20% (3)蒸发结晶(或其他合理答案也可) (4) ABDE
30.(1)氮肥;浓硫酸(浓H2SO4) (2)CO2+2NaOH=Na2CO3+H2O
(3)打开弹簧夹通氮气(或其他合理答案也可)
(4) ![]() 或
或![]()
31.(1)氢气(H2) (2)Cu+2AgNO3=2Ag+Cu(NO3)2
(3)碳、银(或C、Ag) (4)碳、铝(或C、A1)
(5)硝酸铝、硝酸铜和硝酸(或Al(NO3)3、Cu(NO3)2、 HNO3)
32.(1)蓝 (2) 81%(过程略)